 |
| © News1 |
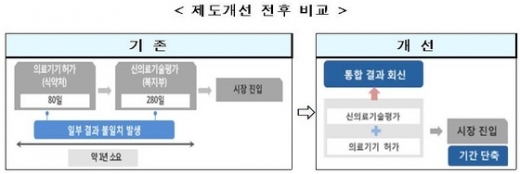
의료기기 제품이 국내 시장에 진출하는데 걸리는 기간이 1년에서 최소 3개월(80일) 정도로 단축된다.
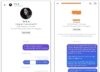
21일 보건복지부와 식품의약품안전처에 따르면 오는 22일부터 의료기기 허가와 신의료기술평가를 한 번에 신청받아 심의·검토하는 시범사업이 진행되면서 의료기기 제품이 국내 시장에 진입하는데 걸리는 기간이 360일(1년)에서 80~140일로 줄어든다.
다만 검토 기간이 연장된 경우에는 시장 진입에 최장 280일이 걸린다.
보건당국은 시범사업을 거쳐 오는 7월 이 제도를 전면 시행할 예정이다.
이 시범사업은 의료기기 업체가 식약처에 평가를 신청하면 식약처가 복지부와 함께 심의한다. 두 기관이 허가와 신의료기술 평가 정보를 함께 공유·조율한 통합허가증이 발급된다.
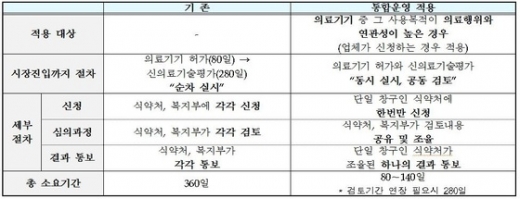
시범사업 적용 대상은 시장 진입을 위해 허가와 신의료기술평가가 모두 필요한 의료기기이다. 의료기기와 의료기술의 사용 목적이 같고 허가받을 때 사람을 대상으로 하는 임상시험이 필요한 경우가 해당한다.
국내에서 의료기기를 판매할 계획이 없고 해외 수출이나 개발도상국 기부 등이 목적이라면 시범사업 대상이 아니다. 시범사업 신청 없이 식약처에 의료기기 허가만 신청하면 된다.
시범사업 세부 내용을 보면 복지부 산하기관인 한국보건의료연구원(NECA)이 식약처에 의료기술에 대한 자료를 제공한다.
식약처는 20명의 전문가들이 신의료기술의 안전성·유효성을 평가하는 신의료기술평가위원회에 참석해 해당 의료기기를 설명한다. 이런 방식으로 두 기관이 의견을 교환해 하나의 결과를 내놓는다.
결과는 식약처가 신청업체에 알려준다. 기존에는 허가와 신의료기술 평가를 식약처와 복지부에 각각 신청하고 심의와 결과 통보도 각각 이뤄져 1년 가까운 기간이 소요됐다.
 |
| 의료기기 통합운영 전후 비교./© News1 |
이와 함께 올해 상반기 유전자 등 안전성 우려가 낮은 검사 분야는 핵심 원리가 같으면 복지부의 신의료기술 평가 대상에서 제외된다. 이에따라 식약처 허가 후 바로 시장 진입이 가능한 대상이 종전 30%에서 60%로 2배로 확대될 전망이다.
7월부터는 의료기기 업체가 허가를 신청할 때만 사용하던 임상시험 자료를 신의료기술평가에도 활용하게 된다. 식약처가 임상시험 계획을 승인할 때 보건의료연구원이 참여해 신의료기술평가 관점에서 자문해주는 방식이다.
또 의료기기 법령에 따라 인정된 임상시험 자료도 출판된 문헌처럼 신의료기술평가 때 이용하기로 했다.
이 같은 조치로 유사한 임상시험이 없어지면 건당 4~10억원의 비용이 절감되고 업체 부담이 줄어들 것으로 보건당국은 예상했다. 복지부·식약처 관계자는 "이번 시범사업으로 의료기기 제품의 시장 진입이 빨라질 것"이라며 "최대한 많은 업체가 신청해주기를 바란다"고 밝혔다.
<저작권자 © 뉴스1코리아, 무단전재 및 재배포 금지>
















![돌연 사라진 70대 재력가…내연녀 집 시멘트 부쉈더니 시신으로[뉴스속오늘]](https://thumb.mt.co.kr/11/2024/04/2024042417433499310_1.jpg/dims/resize/100x/optimize/)




























![영하 13도, 길냥이 죽음 막을…'얼지 않는 물그릇'[남기자의 체헐리즘]](https://thumb.mt.co.kr/10/2024/01/2024012701364573421_1.jpg/dims/resize/100x/optimize)










![민희진 "주주간계약=모순 有"..하이브 "사실 아냐" 해명[★FOCUS]](https://menu.mt.co.kr/upload/main/2024/2024042621482692257147_mainTop.jpg)










![미국 대선, 6개주만 보면 답 나온다 [PADO 편집장의 '미국 대 미국']](https://i4.ytimg.com/vi/7kc1ddGnWtE/hqdefault.jpg)


















